| Propiedades coligativas de las soluciones | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Las propiedades coligativas son propiedades físicas que van a depender del número de partículas desoluto (sustancia que se disuelve un compuesto químico determinado) en una cantidad determinada de disolvente o solvente(sustancia en la cual se disuelve un soluto). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Propiedades Coligativas La presión de vapor: Esta propiedad esta reflejada en la Ley de Raoult, un científico francés, Francois Raoult quien enunció el siguiente principio: “La disminución de la presión del disolvente es proporcional a la fracción molar de soluto disuelto”. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Este principio ha sido demostrado mediante experimentos en los que se observa que las soluciones que contienen líquidos no volátiles o solutos sólidos, siempre tienen presiones más bajas que los solventes puros. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El cálculo de la presión se realiza mediante la fórmula que se muestra a la derecha. Las soluciones que obedecen a esta relación exacta se conocen como soluciones ideales. Las presiones de vapor de muchas soluciones no se comportan idealmente. |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pasos para calcular la presión de vapor de una solución: El planteamiento del problema puede ser el siguiente: Calcule la presión de vapor de una solución a 26°C que contiene 10 gr. de Urea disuelta en 200 gr. de agua. Masa molecular de la urea: 60 g/mol Masa molecular del agua: 18 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Punto de ebullición y de congelación: El punto de ebullición de un líquido es la temperatura a la cual la presión de vapor se iguala a la presión aplicada en su superficie. Para los líquidos en recipientes abiertos, ésta es la presión atmosférica.La presencia de moléculas de un soluto no volátil en una solución ocasiona la elevación en el punto de ebullición de la solución. Esto debido a que las moléculas de soluto al retardar la evaporación de las moléculas del disolvente hacen disminuir la presión de vapor y en consecuencia la solución requiere de mayor temperatura para que su presión de vapor se eleve o iguale a la presión atmosférica. La temperatura de ebullición del agua pura es 100 ºC. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El agua pura hierve a 100°C y la presión del vapor es de 760 mm de Hg. Al preparar una solución de urea 1 molar, ésta solución no hierve a 100°C y la presión de vapor desciende por debajo de 760 mm de Hg. Para que la solución de urea hierva hay que aumentar la temperatura a 100,53°C y elevar la presión a 750 mm de Hg. El punto de ebullición de cualquier disolvente en una solución siempre es mayor que el punto de ebullición del disolvente puro. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Para calcular la variación del punto de ebullición se aplica la siguiente fórmula: | Cálculo del punto de ebullición: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Te: diferencia entre los puntos de ebullición de una solución y del disolvente puro. Ke: constante molal de ebullición. Cuando el disolvente es agua el valor de la constante es: 0,52 ºC Kg/mol m: molalidad | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El punto de congelación de un líquido es la temperatura a la cual la presión de vapor del líquido y del sólido se igualan. El punto de congelación se alcanza en una solución cuando la energía cinética de las moléculas se hace menor a medida que la temperatura disminuye; el aumento de las fuerzas intermoleculares de atracción y el descenso de la energía cinética son las causas de que los líquidos cristalicen. Las soluciones siempre se congelan a menor temperatura que el disolvente puro. La temperatura de congelación del agua pura es 0ºC. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cálculo del punto de congelación: | Tc: diferencia entre los puntos de congelación de una solución y del disolvente puro. Kc: constante molal de congelación. Cuando el disolvente es agua el valor de la constante es: 1,86 ºC Kg/mol m: molalidad | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Aplicación de las fórmulas: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En 392 g de agua se disuelven 85 g de azúcar de caña (sacarosa). Determinar el punto de ebullición y el de congelación de la solución resultante. Masa molecular de la sacarosa: 342 g/mol. Paso 1: determinar la molalidad de la solución: |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Paso 2: Determinar el punto de ebullición y de congelación | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Punto de ebullición: Como el agua hierve a los 100°C, se suma el valor obtenido a 100°C: 100°C + 0,329 = 100,329°C | Punto de congelación: Como el agua se congela por debajo de los 0ºC 0ºC– 1,179 = - 1,179°C. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Presión osmótica:Esta propiedad se basa en el fenómeno de la ósmosis en el cual se selecciona el paso de sustancias a través de una membrana semipermeable que tiene poros muy pequeños que sólo permiten el paso de las moléculas del disolvente pero no del soluto. Esto permite que dos soluciones de diferentes concentraciones separadas mediante una membrana semipermeable igualen sus concentraciones, debido al paso de las moléculas de solvente de la solución más diluida a la solución más concentrada, hasta alcanzar ambas la misma concentración. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El paso del disolvente desde la solución diluida hacia la solución concentrada provoca un aumento de la presión de la solución. Este incremento de la presión que se suma a la presión de vapor de la solución, se conoce como presión osmótica y se representa con la letra | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cálculo de la presión osmótica C: molaridad o molalidad R: valor constante 0,082 L atm/°K x mol T: temperatura expresada en °K. Si el valor de la temperatura está expresado en ºC, se suma a este valor 273. Ejemplo: Temperatura: 20 ºC, 20ºC + 273 = 293ºK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A continuación se presenta un problema tipo de presión osmótica: Halle la presión osmótica de una solución de glucosa que contiene 12 gr. de la sustancia en 500 ml de solución a una temperatura de 298ºK. Masa molecular de la glucosa = (MM): 180 g/mol | Paso 1: Cálculo de la molalidad o molaridad:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Paso 2: Cálculo de la presión osmótica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
REFERENCIAS: Requeijo, D. y Requeijo A. (2002). Química. Editorial Biosfera. Irazábal A. y de Irazábal C. (S/A). Química. Ediciones CO-BO. Mahan. Química. (1977). Fondo Educativo Interamenricano. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
miércoles, 26 de mayo de 2010
http://www.salonhogar.net/Quimica/Nomenclatura_quimica/Propiedades_coligativas.htm
Suscribirse a:
Comentarios de la entrada (Atom)


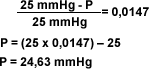


No hay comentarios.:
Publicar un comentario